吴更研究团队在mTOR信号通路研究取得新进展
主要完成人: 发表日期:2018-03-02 点击数:1889
日前,国际学术期刊Cell Discovery在线发表了上海交通大学生命科学技术学院吴更教授团队在mTOR信号通路的结构和功能机制方面的最新研究成果“Structural insight into the Ragulator complex which anchors mTORC1 to the lysosomal membrane”。
mTOR信号传导通路是在单细胞真核生物(如酵母)、植物(如拟南芥)、无脊椎动物(如果蝇)、脊椎动物(如人)中非常保守的一条信号传导通路,负责调节细胞的生长和增殖等重要生命过程。mTOR信号通路中重要基因的突变与多种人类疾病如癌症、糖尿病等密切相关。Ragulator五元蛋白质复合物是mTOR信号通路中非常重要的一个复合物,它通过Lamtor1亚基定位在溶酶体的表面,并通过其所结合的RagA-RagC GTPase复合物招募mTORC1复合物到溶酶体表面,从而被Rheb蛋白所激活。
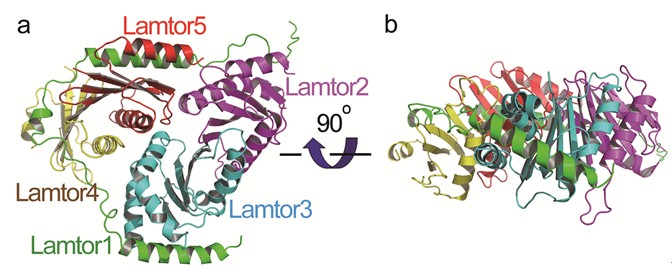
研究人员解析了人源Ragulator五元蛋白质复合物的晶体结构,发现该复合物的Lamtor1亚基像一根皮带一样,把其他四个亚基Lamtor2、Lamtor3、Lamtor4、Lamtor5裹在一起。揭示了Lamtor4和Lamtor5缺乏alpha3螺旋结构,通过Lamtor1的两段螺旋嵌在Lamtor4和Lamtor5上对应于Lamtor2和Lamtor3的alpha3螺旋的位置,从而稳定了Lamtor2和Lamtor3的结构。研究还发现,酵母的Ego复合物仅对应于Ragulator的三个亚基(Lamtor1的C端、Lamtor2和Lamtor5),可能存在尚未发现的其他亚基。
该成果是吴更教授团队近年来发表的关于mTOR信号传导通路的蛋白质复合物结构功能研究的第三篇论文。在前两篇论文中,吴更教授团队报导了mTOR信号传导通路中肿瘤抑制蛋白TSC1的C末端coiled coil与TBC1D7的复合物晶体结构,阐明了TBC1D7有着稳定TSC1的C末端coiled coil二聚化的重要作用(Gai et al., Journal of Molecular Cell Biology, 8:411-425, 2016);解析了mTOR信号传导通路的精氨酸感应器CASTOR1与精氨酸的复合物结构,揭示了CASTOR1特异性识别精氨酸,以及精氨酸诱导CASTOR1发生构象变化解除CASTOR1对下游的GATOR2复合物的抑制的分子机理(Gai et al., Cell Discovery, 2:16051, 2016)。