科研进展 | 微生物代谢国家重点实验室科研团队在细菌Ⅵ型蛋白分泌系统合成机制方面取得新进展
主要完成人: 发表日期:2021-02-25 点击数:746
近日,上海交通大学微生物代谢国家重点实验室董涛团队揭示了细菌Ⅵ型蛋白分泌系统(T6SS)的合成调控新机制。相关成果以“TssA–TssM–TagA interaction modulates type VI secretion system sheath-tube assembly in Vibrio cholerae”为题发表于《Nature Communications》杂志。博士研究生梁小夜和李浩为共同作者,董涛研究员为通讯作者。
T6SS广泛存在于革兰氏阴性菌中,是革兰氏阴性菌重要的毒力决定因子,在微生物竞争与感染宿主中发挥重要作用。长约1微米的管状结构是T6SS的典型特征,由内外双层管组成(图1-a),外管结构类似于弹簧,可以在2毫秒内收缩至原长的一半,并释放出相当于1000个ATP分子的水解能,同时使内管直接穿透细胞内外膜和细胞壁,将具有抗菌活性或细胞毒性的效应蛋白注射到受体细胞内。然而其合成和收缩机制一直是领域内尚未解决的重要问题。
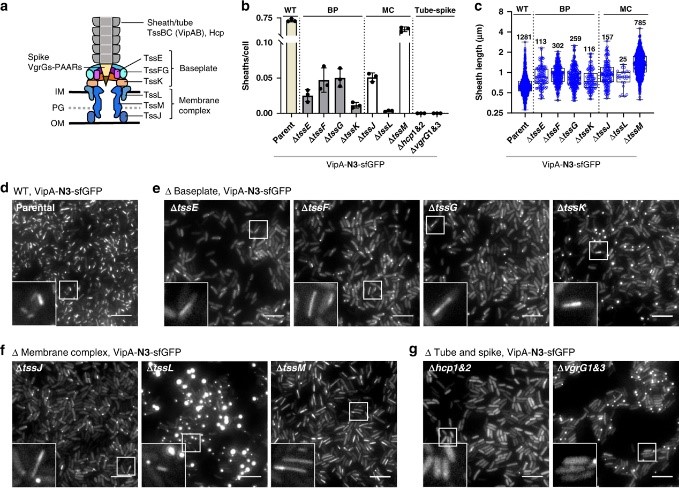
图1 T6SS尾部管状结构
法国科学家先后于2016年和2018年提出了由TssA和TagA作为关键合成起始因子和终止因子的T6SS组装模型。董涛团队通过创新性地构建和运用一系列T6SS结构蛋白基因敲除突变体和T6SS不可伸缩模型,成功将T6SS合成起始过程和延伸过程区分开,并发现在缺失跨膜结构基因的突变体中仍有T6SS管状结构蛋白合成,这些现象并无法被原有模型解释。通过进一步对起始因子TssA、终止因子TagA和内膜蛋白TssM等关键元件的功能进行细致的生化和遗传研究,该团队成功地提出了一个由TssA-TssM-TagA共同控制T6SS合成的新模型。
.png)
图2 TssA–TssM–TagA控制T6SS合成的新模型
此外,对T6SS来源的研究发现,其跨膜蛋白复合物中的TssM和TssL蛋白与IV蛋白分泌系统(T4SS)的膜蛋白同源,而尾部管状结构与噬菌体的可收缩尾管同源。这一发现很好地解释了在特定条件下T6SS的管状结构能够不依赖跨膜蛋白复合物而独立合成现象,使我们依旧可以看到在漫长的进化过程中T4SS和噬菌体被细菌整合T6SS时留下的痕迹。
上述研究是董涛团队近两年来在T6SS分泌蛋白作用及合成机制方面的延续和补充,对理解T6SS的作用机制起到了推动作用。系列研究获得国家自然科学基金委面上项目(31770082)等支持,成果相继发表在PNAS、Nat Microbiol、Nat Commun等期刊。
文章链接:http://www.nature.com/articles/s41467-020-18807-9