科研进展 | 微生物代谢国家重点实验室 链霉菌调控因子转录的分子机制取得重要进展
主要完成人: 发表日期:2022-07-25 点击数:3748
近日,上海交通大学微生物代谢国家重点实验室郑舰艇课题组在《Nucleic Acids Research》上发表题为“Structural basis of Streptomyces transcription activation by zinc uptake regulator”的研究论文。该论文通过生化实验和冷冻电镜相结合,揭示了天蓝色链霉菌转录因子Zur通过与RNA聚合酶(RNAP)α亚基的碳端结构域(αCTD)互作激活锌外排蛋白编码基因zitB的转录,为理解Zur依赖的转录激活提供了基础。上海交通大学博士生杨旭为该论文第一作者,郑舰艇长聘副教授为通讯作者。
链霉菌天然产物是小分子药物的重要来源,其生物合成过程受到严格的调控,特别是在转录起始阶段。天蓝色链霉菌反式调控因子Zur通过与启动子DNA序列中的Zur-box结合,调控细胞内锌离子(Zn2+)浓度稳态,进而影响发育分化和天然产物合成。因此研究Zur与DNA的结合方式,解析Zur激活RNAP的机制,对理解Zur依赖的转录调控具有重要意义。
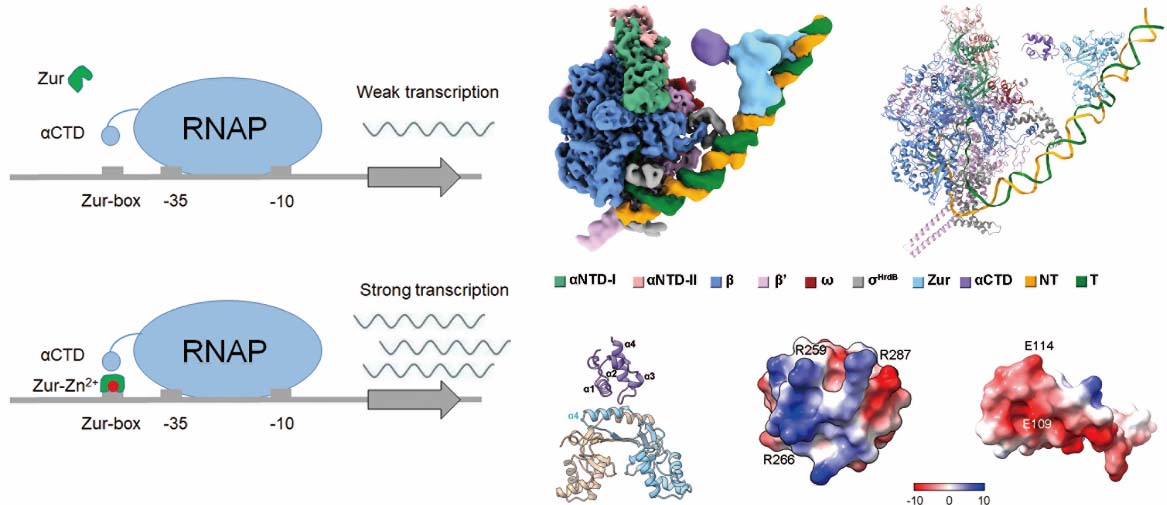
本研究首先利用体外转录实验证明了在体系中存在高浓度Zn2+时,Zur-Zn2+通过结合到zitB启动子上游的顺式DNA元件激活zitB的转录,且激活作用发生在RNAP与启动子开放复合物形成13 bp的转录泡之前;并通过冷冻电镜手段解析了Zur-DNA复合物和Zur-DNA-RNAP转录激活复合物的三维结构。Zur-DNA复合物的结构显示,Zur以三个二聚体形式顺序协同结合在Zur-box序列上,与体外凝胶阻滞实验的结果一致;Zur-DNA-RNAP转录激活复合物的结构揭示了链霉菌RNAP中参与识别启动子DNA的关键氨基酸位点,以及结合调控因子Zur的位点。RNAP的αCTD通过电荷互补与Zur相互作用,突变相互作用界面的关键氨基酸可以使Zur丧失转录激活功能。
该研究不仅丰富了对链霉菌转录起始步骤的认识,也为理解Zur依赖的转录激活的分子机制提供了基本框架。
本研究获得国家重点研发计划和国家自然科学基金面上项目资助。